NH3+H2O=NH4++OH-
Kb(NH3•H2O)=1.8×10-5;
HPO42-+H2O=H2PO4-+OH-
Kb2=Kw/Ka2=10-14/(6.3×10-8)=1.58×10-7
由此可见,NH3•H2O的碱性要强。
(简答题)
请用质子酸碱理论解释在水溶液中NH3与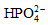 哪一个碱性强?(已知:Kb(NH3•H2O) = 1.8×10-5;H3PO4
哪一个碱性强?(已知:Kb(NH3•H2O) = 1.8×10-5;H3PO4 = 7.6×10-3,
= 7.6×10-3,  = 6.3×10-8,
= 6.3×10-8,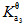 = 4.4×10-13)
= 4.4×10-13)
正确答案
答案解析
略
相似试题
(简答题)
用酸碱质子理论解释水分对非水溶液滴定酸和碱的影响。
(单选题)
根据酸碱质子理论,在水溶液中既可作酸亦可作碱的物质是()。
(简答题)
应用软硬酸碱理论解释在稀AgNO3溶液种依次加入NaCl,NH3,KBr,Na2S2O3,KI,KCN,Ag2S产生沉淀、溶解交替的原因?
(填空题)
根据酸碱质子理论,NH3+CH2COOH的共轭碱是()。
(多选题)
在酸碱质子理论中,可作为酸的物质是().
(单选题)
根据酸碱质子理论,下列物质中只是酸的有()
(简答题)
以下哪些物种是酸碱质子理论的酸、哪些是碱,哪些具有酸碱两性?SO42-、S2-、H2PO4-、NH3、HSO4-、[Al(H2O)2OH]2+、CO32-、NH4+、H2S、H2O、OH-、H3O+、HS-、HPO42-、SO42-。
(填空题)
NH3-NH4Cl缓冲溶液的质子条件式()。
(填空题)
酸碱质子理论中,酸给出质子后变成碱,而碱接受质共轭关系子便成为酸,酸与碱的这种相互依存的关系称为()


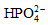 哪一个碱性强?(已知:Kb(NH3•H2O) = 1.8×10-5;H3PO4
哪一个碱性强?(已知:Kb(NH3•H2O) = 1.8×10-5;H3PO4 = 7.6×10-3,
= 7.6×10-3,  = 6.3×10-8,
= 6.3×10-8,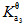 = 4.4×10-13)
= 4.4×10-13) 