根据N2的UPS谱图可知:
第一谱带的振动波数为2100cm-1,比氮气分子的振动波数(2345cm-1)降低了许多,说明N2分子激发一个电子后平衡核间距变长,又由于该谱带的振动序列很短,因此产生该谱带的电子来源于弱成键轨道。
第二谱带的振动波数为1810cm-1,比氮气分子的振动波数(2345cm-1)降低了许多,说明N2分子激发一个电子后平衡核间距变长,且该谱带的振动序列比较长,因此产生该谱带的电子来源于强成键轨道。
第三谱带的振动波数为2390cm-1,比氮气分子的振动波数(2345cm-1)略高了一些,说明N2分子激发一个电子后平衡核间距略为变短,但该谱带的振动序列很短,说明产生该谱带的电子来源于弱反键轨道。
根据以上分析可知,氮气分子的价电子组态为(1σg)2(1σu)2(1πu)4(2σg)2。其中(2σg)、(1πu)和(1σu)分别为弱成键、强成键、弱反键轨道,这些轨道上的电子的垂直跃迁分别对应于第一、二、三谱带。
(简答题)
已知下图为氮气分子的紫外光电子能谱,请根据该谱图分析氮气分子的前线分子轨道的性质。(已知氮气分子的振动波数为2345cm-1, 第一谱带的振动波数为2100cm-1,第二谱带的振动波数为1810cm-1,第三谱带的振动波数为2390cm-1) 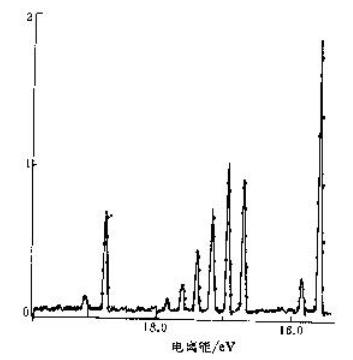
正确答案
答案解析
略
相似试题
(简答题)
XPS和UPS分别可以提供那些分子结构信息?如何从紫外光电子能谱来区别分子轨道的成键与反键性质?其理论依据是什么?
(单选题)
在紫外光电子能谱上,能峰在横坐标上的排列顺序与()相对应
(简答题)
已知某化合物的分子式为C5H8O,它的红外吸收带的频率为:3020,2900,1690和1620cm-1,在紫外吸收在227nm(ε=104)。试提出其结构。
(填空题)
核磁共振普与红外、紫外一样,实际上都是()。红外光谱来源于分子振动-转动能级间的跃迁,紫外-可见吸收光谱来源于分子的电子能级间的跃迁。
(简答题)
下图所示分子的实测偶极矩为1.5D,已知C-S键的键矩为0.9D,试推测该分子的可能立体结构。
(填空题)
α、β、γ射线及中子射线、原子射线、电子射线、紫外线等都属于射线类,当这些射线穿过食品或农产品时,会对分子起到离子化作用,这种现象叫做()。
(简答题)
根据同核双原子分子的电子组态可以预见分子及离子的性质。已知O2及其离子的键长有如下数据,请画出它们的对应关系。
(简答题)
已知封闭的圆环中粒子的能级为:n=0,±1,±2,±3… 式中n为量子数,R是圆环的半径,若将此能级公式近似地用于苯分子中π66离域π键,取R=140pm,试求其电子从基态跃迁到第一激发态所吸收的光的波长。
(简答题)
有第四周期的A、B、C、D四种元素,它们的价电子数依次为1、2、2、7,且原子序数A、B、C、D依次增大,已知A与B的次外层电子数为8,C与D次外层电子数为18,试问: (1)那些是金属元素? (2)A、B、C、D的原子序数及电子结构式是什么? (3)B、D两元素,问能否形成化合物?写出分子式。



