(单选题)
25℃时,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度均为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法不正确的是()。 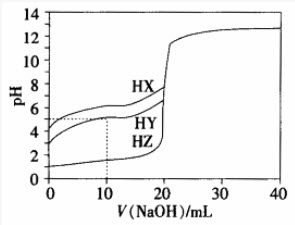
A在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ>HY>HX
B根据滴定曲线,可得Ka(HY)≈10-5
C将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(Y-)>c(X-)>c(OH-)>c(H+)
DHY与HZ混合,达到平衡时:
正确答案
答案解析
略
相似试题
(简答题)
在500mL1.0mol/L的CuSO溶液中,阳极为100g的铜片,阴极为100g锌片,通电一段时间后,立即去除电极,测得锌片质量增加到106.4g,此时剩余溶液中CuSO的物质的量的浓度为()。 A.0.25mol/L B.0.8mol/L C.1.0mol/L D.1.2mol/L 某学生给出的答案是B。 请你分析,B选项是正确答案吗?如果是正确答案,请你列出分析过程。如不是,请你给出正确答案。并请你试着分析该生答错的可能原因。
(单选题)
浓度均为0.1mol·L的三种溶液等体积混合,充分反应后没有沉淀的一组溶液是()。
(简答题)
背景材料: 在某100mL的混合液中,硝酸和硫酸物质的量浓度分别是0.4mol/L、0.1mol/L,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是()mol/L。 A.0.15 B.0.225 C.0.35 D.0.45
(简答题)
背景材料: 在某100mL的混合液中,硝酸和硫酸物质的量浓度分别是0.4mol/L、0.1mol/L,向该混合液中加入1.92g铜粉,加热,待充分反应后,所得溶液中铜离子物质的量浓度是()mol/L。 A.0.15 B.0.225 C.0.35 D.0.45
(简答题)
阅读下列三个材料,按要求完成任务。 材料一普通高中化学课程标准 【内容标准】通过实验认识化学反应的速率和化学反应的限度,了解控制反应条件在生产和科学研究中的作用。 【活动建议】实验探究:温度、催化剂对过氧化氢分解反应速率的影响。 设计实验:证明某些化学反应的可逆性。 材料二某教科书的知识结构体系 第一章物质结构元素周期律 第二章化学反应与能量 第一节化学能与热能 第二节化学能与电能 第三节化学反应速率和限度 材料三某版高中实验教科书,《化学》第二章第三节"化学反应速率和限度"部分内容 化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。浓度常以mol/L为单位,时间常以min(分)或s(秒)为单位,化学反应速率的单位相应为mol/(L·min)或mol/(L·s)。例如,某反应的反应物浓度在5min内由6mol/L变成2mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为0.8mol/(L·min)。 有哪些条件能够影响化学反应速率呢?我们通过下面的实验来进行探究。 【实验2-5】 在2支大小相同的试管中,装入2~3mL,约5%的H2O2溶液,分别滴入1~2滴1mol/LFeCl溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有5℃左右的冷水的烧杯中;另一支试管放入盛有40℃左右的热水的烧杯中,对比观察现象。待放入热水烧杯中的试管里出现大量气泡时,用带火星的火柴梗检验放出的气体。 要求: (1)确定本课的三维教学目标。 (2)确定本课的教学难点和重点。 (3)写出实验2-5的现象。 (4)由上述发生的反应可得出什么结论? (5)给本节课设计一个板书。
(简答题)
背景材料: 某教师按如下教学设计组织学生研究"物质定量检测实验": 新装修的家居中,甲醛的浓度往往很高,严重污染空气,危害居住者的身体健康。利用甲醛可以使高锰酸钾褪色的反应,可以检测室内甲醛的含量: SHCHO+4KMnO4+6H2SO4=SCO2+11H2O+2K2SO4+4MnSO4 实验过程如下: ①配制100mL1.00×10-4mol·L-1KMnO4溶液; ②用2.5mL注射器量取2mL上述KMnO4溶液注入井穴板的孔内,再滴加3滴6mol·L-1H2SO4溶液: ③将此装置置于待测地点,用50mL大注射器向溶液中鼓气,每次鼓气50mL,直到溶液红色褪去,记录抽气次数。 回答问题:①设抽气次数为n,试计算甲醛在空气中的含量(mg/m3)。 ②为了保证实验结果的准确性,实验过程应注意什么? ③如果让你根据这一原理设计一种检测空气甲醛浓度的仪器,你能想到哪些设计方案?
(简答题)
背景材料; 化学反应的速率和限度 我们在前面的学习中,主要讨论了化学反应中的物质变化及伴随发生的能量变化这两个根本问题,这是化学反应的两大特征。当一个具体的化学反应应用于实际时,人们最关心的问题是什么呢?这就是我们下面要讨论的问题。 一、化学反应的速率 思考与交流 在化学实验和日常生活中,我们经常观察到这样的现象:有的化学反应进行得快,有的化学反应进行得慢。你了解下列化学变化过程进行得快慢吗?反应的快慢与我们有什么关系? ①炸药爆炸;②金属锈蚀;③食物腐败;④离子反应;⑤塑料老化;⑥溶洞形成。 不同的化学反应进行得快慢千差万别,“快”与“慢”是相对而言的,是一种定性的比较,通常要确定一个参照物。在科学研究和实际应用中,需要对化学反应的快慢进行定量的描述或比较,这就要使用同一定义或标准下的数据。与物理学中物体的运动快慢用“速度”表示相类似,化学反应过程进行得快慢用“反应速率”来表示。 化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。浓度常以mol/L为单位,时间常以min(分)或s(秒)为单位,化学反应速率的单位相应为mol/(L·min)或mol/(L·s)。例如,某反应的反应物浓度在5min内由6mol/L变成了2mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为0.8mol(L·min)。 有哪些条件能够影响化学反应的速率呢?我们通过下面的实验来进行探究。 实验1 在2支大小相同的试管中,装入2~3mL约5%的HO溶液,分别滴入1~2滴lm01/LFeCl溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有5℃左右冷水的烧杯中;另一支试管放入盛有40℃左右热水的烧杯中,观察现象并进行对比。待放入热水烧杯中的试管里出现大量气泡时,用带火星的火柴梗检验放出的气体。 实验2 在3支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末、1~2滴1mol/LFeCl3溶液,对比观察现象。 从实验1我们观察到,升高温度,H2O2分解反应速率增大;降低温度,H2O2分解反应速率减小。大量实验和理论研究表明,温度对化学反应速率的影响具有相同的规律性。因此,通常可以采用调控温度的办法来控制化学反应速率。 从实验2我们观察到,MnO2、FeCl3可以加快H2O2分解的反应速率,起了催化剂的作用。催化剂在化工生产中应用十分普遍,新的催化剂的问世,常常意味着化工生产工艺的一次革新和进步。 影响化学反应速率的条件并不只是温度和催化剂。如果我们细心观察和思考,就会发现生活中和化学实验中采取的很多措施都是用来调控反应速率的。 1.为什么要将食物存放在温度低的地方(如电冰箱)? 2.实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么? 3.人们常把固体试剂溶于水配成溶液后再进行化学实验,原因是什么? 4.实验室常用约30%左右的硫酸溶液(约3.7 mol/L)与锌粒反应制取氢气,当反应进行 一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么? 从上面的实验和事例可以看出,温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等都可以影响化学反应的速率,人们可以通过这些因素来调控化学反应速率。
(简答题)
背景材料; 化学反应的速率和限度 我们在前面的学习中,主要讨论了化学反应中的物质变化及伴随发生的能量变化这两个根本问题,这是化学反应的两大特征。当一个具体的化学反应应用于实际时,人们最关心的问题是什么呢?这就是我们下面要讨论的问题。 一、化学反应的速率 思考与交流 在化学实验和日常生活中,我们经常观察到这样的现象:有的化学反应进行得快,有的化学反应进行得慢。你了解下列化学变化过程进行得快慢吗?反应的快慢与我们有什么关系? ①炸药爆炸;②金属锈蚀;③食物腐败;④离子反应;⑤塑料老化;⑥溶洞形成。 不同的化学反应进行得快慢千差万别,“快”与“慢”是相对而言的,是一种定性的比较,通常要确定一个参照物。在科学研究和实际应用中,需要对化学反应的快慢进行定量的描述或比较,这就要使用同一定义或标准下的数据。与物理学中物体的运动快慢用“速度”表示相类似,化学反应过程进行得快慢用“反应速率”来表示。 化学反应速率通常用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示。浓度常以mol/L为单位,时间常以min(分)或s(秒)为单位,化学反应速率的单位相应为mol/(L·min)或mol/(L·s)。例如,某反应的反应物浓度在5min内由6mol/L变成了2mol/L,则以该反应物浓度的变化表示的该反应在这段时间内的平均反应速率为0.8mol(L·min)。 有哪些条件能够影响化学反应的速率呢?我们通过下面的实验来进行探究。 实验1 在2支大小相同的试管中,装入2~3mL约5%的HO溶液,分别滴入1~2滴lm01/LFeCl溶液。待试管中均有适量气泡出现时,将其中一支试管放入盛有5℃左右冷水的烧杯中;另一支试管放入盛有40℃左右热水的烧杯中,观察现象并进行对比。待放入热水烧杯中的试管里出现大量气泡时,用带火星的火柴梗检验放出的气体。 实验2 在3支大小相同的试管中各装入2~3mL约5%的H2O2溶液,再向其中2支试管中分别加入少量MnO2粉末、1~2滴1mol/LFeCl3溶液,对比观察现象。 从实验1我们观察到,升高温度,H2O2分解反应速率增大;降低温度,H2O2分解反应速率减小。大量实验和理论研究表明,温度对化学反应速率的影响具有相同的规律性。因此,通常可以采用调控温度的办法来控制化学反应速率。 从实验2我们观察到,MnO2、FeCl3可以加快H2O2分解的反应速率,起了催化剂的作用。催化剂在化工生产中应用十分普遍,新的催化剂的问世,常常意味着化工生产工艺的一次革新和进步。 影响化学反应速率的条件并不只是温度和催化剂。如果我们细心观察和思考,就会发现生活中和化学实验中采取的很多措施都是用来调控反应速率的。 1.为什么要将食物存放在温度低的地方(如电冰箱)? 2.实验时,通常要将两种块状或颗粒状的固体药品研细,并混匀后再进行反应。原因是什么? 3.人们常把固体试剂溶于水配成溶液后再进行化学实验,原因是什么? 4.实验室常用约30%左右的硫酸溶液(约3.7 mol/L)与锌粒反应制取氢气,当反应进行 一段时间后,气泡变得稀少了(锌粒还有剩余),如果添加一些适当浓度的硫酸溶液到反应容器中,气泡又会重新增多起来。原因是什么? 从上面的实验和事例可以看出,温度、固体的表面积、反应物的状态、溶液的浓度、催化剂等都可以影响化学反应的速率,人们可以通过这些因素来调控化学反应速率。
(简答题)
背景材料: 某化学教师在一次化学测验中设计了下列试题.并对部分学生的解题结果进行了统计和分析 【试题】重水(DO)的离子积为1.6×10-15,可以用pH一样的定义来规定pD=-lgc(D+)。下列关于pD叙述正确的是 A.中性溶液的pD=7.0 B.1L含0.01mol的NaOD的D2O溶液,其pD=12.0 C.1L含0.01mol的DCl的DO2溶液,其pD=2.0 D.在100ml0.25mol·L-1的DCl重水溶液中.加入50ml0.20mol·L-1的NaOD的重水溶液,所得溶液的pD=1.0 【考试结果】全体考生的答题情况统计如下:



