(单选题)
今有三个氧化还原反应: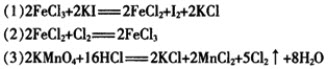 若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是()。
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是()。
ACl3
BKMnO4
CFeCl3
DHCl
正确答案
答案解析

相似试题
(简答题)
阅读下面文字,回答有关问题:某化学学习小组欲探究铁及其化合物的氧化性和还原性。(1)实验试剂及仪器:氯化亚铁溶液、氯化铁溶液、氯水、KSCN溶液、铁粉、锌片、铜片、稀硫酸、胶头滴管、试管(2)实验记录 问题:(1)在实验②中,有部分同学在氯化亚铁溶液中滴入KSCN溶液后,就出现了血红色,可能的原因是什么?(2)在配制氯化铁溶液时,由于实验员失误,可能导致溶液中含有少量的Fe2+ ,如何检验是否有少量Fe的存在?(3)作为教师,在进行实验探究教学时,应注意哪些方面?
(单选题)
下列应用不涉及氧化还原反应的是()。
(单选题)
下列反应中生成物总能量高于反应物总能量且属于氧化还原反应的是()。
(单选题)
茫茫黑夜中,航标灯为航海员指明了方向。航标灯的电源必须长效、稳定。我国科技工作者研制出铝合金、Pt-Fe合金网为电极材料的海水电池。在这种电池中()。①铝合金是阳极;②铝合金是负极;③海水是电解质溶液;④铝合金电极发生氧化还原反应。
(简答题)
背景材料: 依据氧化还原反应:设计的原电池如图所示。
(简答题)
标准状况下,往100mL0.2mol/L的FeBr2溶液中通入一定体积的Cl2,充分反应后,溶液中有50%的Br-被氧化。则通入的氯气的体积是多少?上面是某学校化学测试中的一道题,回答下列问题:(1)分析考试中学生可能出现的错误及原因。(2)对本题给出正确的解答。
(简答题)
背景材料: 阅渎下列三段高中化学教学中有关“铁的重要化合物”的材料。 材料一《普通高中课程标准(实验)》的内容标准:根据生产、生活中的应用实例或通过实验探究,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用。 材料二“铁的重要化合物”内容属于高中化学必修阶段的无机元素化合物教学内容,必修化学课程中的无机元素化合物知识安排在《化学1》的“主题3常见无机物及其应用”中。普通高中课程标准使用教科书《化学1》的目录: 第一章从实验学化学 第二章化学物质及其变化 第三章金属及其化合物 第一节金属的化学性质 第二节几种重要的金属化合物 第三节用途广泛的金属材料 第四章非金属及其化合物 材料三以下是某教师设计的教学活动: 【学生活动】阅读教材关于铁的氧化物的介绍,利用分类法归纳FeO、Fe2O3、Fe3O4的性质,并填写表格。 【学生实验1】氢氧化铁、氢氧化亚铁的制备与Fe3+离子检验(整合实验)。 【问题情景1】阅读课文,结合实验现象,思考与讨论: 1.利用KSCN溶液,可以根据什么现象检验溶液中Fe3+的存在?Fe2+离子遇到KSCN会产生相同的现象吗? 2.FeSO4溶液滴加KSCN溶液一段时间后,再次观察溶液的颜色,出现了什么变化?该变化说明了什么?由此你可以得出什么结论? 3.Fe(OH)2沉淀是什么颜色?为什么往FeSO4溶液中滴加NaOH溶液后生成的沉淀会出现颜色变化? 【师生小结】 【问题情景2】 1.从Fe2+被O2氧化为Fe3+,体现了Fe2+的什么性质?除了O2,还有哪些物质可以氧化Fe2+? 2.若要实现从Fe3+转为Fe2+的变化,需要加入什么物质? 【学生实验2】Fe2+与Fe3+的转化,按照教材P)61科学探究进行实验,观察与记录实验现象。 【问题情景3】结合实验探究的现象,思考与讨论: l.Fe3+与铁粉充分反应后的产物是什么?如何证明? 2.回忆前面有关Fe2+的实验,为什么用Fe与稀硫酸制备FeSO4溶液,并保持铁过量? 3.实验中如何判断Fe3+已充分反应?反应不充分对实验结果有何影响? 【师生小结】 【问题情景3】学生课后思考与讨论 通过学习我们知道,Fe2+离子和Fe(OH)2中+2价的铁均易被氧化。根据所学的知识,思考:利用FeSO4溶液和NaOH溶液时,如何通过实验条件的控制,制备较纯净的Fe(OH)2白色沉淀? 请根据上述材料,完成“铁的化合物”这一教学片段的有关任务:
(单选题)
反应中,氧化剂与还原剂的质量之比是()。
(简答题)
背景材料: 阅渎下列三段高中化学教学中有关“铁的重要化合物”的材料。 材料一《普通高中课程标准(实验)》的内容标准:根据生产、生活中的应用实例或通过实验探究,了解钠、铝、铁、铜等金属及其重要化合物的主要性质,能列举合金材料的重要应用。 材料二“铁的重要化合物”内容属于高中化学必修阶段的无机元素化合物教学内容,必修化学课程中的无机元素化合物知识安排在《化学1》的“主题3常见无机物及其应用”中。普通高中课程标准使用教科书《化学1》的目录: 第一章从实验学化学 第二章化学物质及其变化 第三章金属及其化合物 第一节金属的化学性质 第二节几种重要的金属化合物 第三节用途广泛的金属材料 第四章非金属及其化合物 材料三以下是某教师设计的教学活动: 【学生活动】阅读教材关于铁的氧化物的介绍,利用分类法归纳FeO、Fe2O3、Fe3O4的性质,并填写表格。 【学生实验1】氢氧化铁、氢氧化亚铁的制备与Fe3+离子检验(整合实验)。 【问题情景1】阅读课文,结合实验现象,思考与讨论: 1.利用KSCN溶液,可以根据什么现象检验溶液中Fe3+的存在?Fe2+离子遇到KSCN会产生相同的现象吗? 2.FeSO4溶液滴加KSCN溶液一段时间后,再次观察溶液的颜色,出现了什么变化?该变化说明了什么?由此你可以得出什么结论? 3.Fe(OH)2沉淀是什么颜色?为什么往FeSO4溶液中滴加NaOH溶液后生成的沉淀会出现颜色变化? 【师生小结】 【问题情景2】 1.从Fe2+被O2氧化为Fe3+,体现了Fe2+的什么性质?除了O2,还有哪些物质可以氧化Fe2+? 2.若要实现从Fe3+转为Fe2+的变化,需要加入什么物质? 【学生实验2】Fe2+与Fe3+的转化,按照教材P)61科学探究进行实验,观察与记录实验现象。 【问题情景3】结合实验探究的现象,思考与讨论: l.Fe3+与铁粉充分反应后的产物是什么?如何证明? 2.回忆前面有关Fe2+的实验,为什么用Fe与稀硫酸制备FeSO4溶液,并保持铁过量? 3.实验中如何判断Fe3+已充分反应?反应不充分对实验结果有何影响? 【师生小结】 【问题情景3】学生课后思考与讨论 通过学习我们知道,Fe2+离子和Fe(OH)2中+2价的铁均易被氧化。根据所学的知识,思考:利用FeSO4溶液和NaOH溶液时,如何通过实验条件的控制,制备较纯净的Fe(OH)2白色沉淀? 请根据上述材料,完成“铁的化合物”这一教学片段的有关任务:


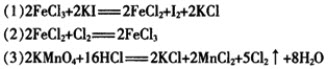 若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是()。
若某溶液中有Fe2+、I-和Cl-共存,要氧化除去I-而不影响Fe2+和Cl-,可加入的试剂是()。 