(多选题)
由公式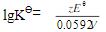 可见,溶液中氧化还原反应的平衡常数Kθ()。
可见,溶液中氧化还原反应的平衡常数Kθ()。
A与浓度无关
B与浓度有关
C与反应书写有关
D与反应书写无关
正确答案
答案解析
略
相似试题
(简答题)
是否平衡常数大的氧化还原反应就能用于氧化还原滴定分析中?为什么?
(简答题)
任何氧化还原电对的标准还原电位都是由半电池反应确定的。NAD+/NADH和丙酮酸/乳酸的标准还原电位分别为-0.32V和-0.19V。 (a)哪一个共轭电对有较大失去电子的倾向? (b)哪一个共轭电对有较强的氧化能力? (c)如果在pH7时,每一反应物和生成物的浓度为1M,试问下列反应进行的方向。丙酮酸+NADH+H+=乳酸+NAD+ (d)在25℃,此反应的标准自由能的变化ΔG°†。 (e)在25℃,此反应的平衡常数?
(简答题)
[Ag(CN)2]-的不稳定常数是1.0×10-20,若把1g银氧化并溶入含有1.0×10-1mol·dm-3CN-的1dm-3溶液中,试问平衡时Ag+的浓度是多少?
(填空题)
氧化还原反应进行的方向一定是电极电势大的电对的()作为氧化剂与电极电势小的电对的还原型作为还原剂反应,直到两电对的电势差=(),即反应达到平衡。
(单选题)
以()作为指示剂测定食品中还原糖的含量,到达反应终点时,溶液的颜色变化是溶液由蓝色到蓝色消失时即为滴定终点。
(简答题)
将10ml0.30mol.L-1的HCOONa与20ml0.15mol.L-1的HF混合.计算反应的平衡常数和溶液中的[HCOO-],[F-]和[H+]各为多少?
(单选题)
给定可逆反应,当温度由T1升至T2时,平衡常数K2>K1,则该反应的()
(简答题)
已知(Cr(OH)3)=6.3×10–31,反应Cr(OH)3+OH===[Cr(OH)4]-的平衡常数KΘ=0.40。 (1)计算Cr3+沉淀完全时溶液的pH值; (2)若将0.1mol·L–1Cr(OH)3刚好溶解在1.0LNaOH溶液中,则NaOH溶液的初浓度至少为多少? (3)计算[Cr(OH)4]-的标准稳定常数。
(填空题)
由氧化还原酶类所催化的反应可用()(通式)。该类酶的辅酶或辅基一般为()


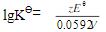 可见,溶液中氧化还原反应的平衡常数Kθ()。
可见,溶液中氧化还原反应的平衡常数Kθ()。 